თუ ორ მეტალს ჩავუშვებთ ელექტროლიტის ხსნარში,მათ შორის
წარმოიქმნება ძაბვა. ასეთ სისტემას მეტალი1/ელექტროლიტის
ხსნარი/მეტალი2 გალვანური ელემენტი ეწოდება.
გალვანური ელემენტი არის დენის წყარო. მისი საშუალებით ქიმიური რეაქციის შედეგად მიიღება ელექტრული დენი (წარმოიქმნება ელექტრომამოძრავებელი ძალა).
გალვანური ელემენტი არის დენის წყარო. მისი საშუალებით ქიმიური რეაქციის შედეგად მიიღება ელექტრული დენი (წარმოიქმნება ელექტრომამოძრავებელი ძალა).
გალვანური ელემენტი ორი ნაწილისაგან შედგება:
- ერთში წარიმართება ჟანგვის პროცესი (ანოდი)
- მეორეში კი აღდგენის პროცესი (კათოდი)
გალვანური ელემენტის კლასიკური მაგალითია დანიელის ელემენტი, რომელიც 1836 წელს შექმნა
ინგლისელმა მეცნიერმა დანიელმა, ხოლო 1838 წელს კი გააუმჯობესა რუსმა ფიზიკოსმა იაკობიმ.
ამიტომ ამ ელემენტს დანიელი-იაკობის ელემენტი
უწოდეს.
მისი ერთი ნაწილი შედგება თუთიის ღეროსაგან, რომელიც
ჩაშვებულია ZnSO4 თუთიის სულფატის ხსნარში, ხოლო მეორე შედგება- სპილენძის
ღეროსაგან, რომელიც ჩაშვებულია CuSO4 სპილენძის სულფატის
ხსნარში.
Zn/ZnSO4
– მიმდინარეობს ჟანგვის პროცესი
CuSO4/Cu- მიმდინარეობს
აღდგენის პროცესი
Cu ასრულებს
კათოდის როლს. თუ ამ ორ ელემენტს მარილის ხიდაკით დავუკავშირებთ, სადაც კალიუმის ქლორიდის
ხსნარია KCl მოთავსებული (ის ელექტროგამტარის როლს ასრულებს), წარმოიქმნება ე.წ. დანიელის
ელემენტი, სადაც ელექტრონები აქტიური მეტალიდან (Zn) მიემართება პასიური მეტალისკენ
(Cu) და გალვანურ წრედში წარმოიქმნება ელექტრული დენი.
დანიელის ელემენტი
სქემატურად ასე გამოისახება Zn/ZnSO4/ CuSO4/Cu U = 1,1ვ
წრედის შეკვრის
შედეგად ელემენტში მიმდინარეობს ჟანგვა-აღდგენითი რეაქცია:
ყოველი გალვანური
ელემენტი შედგება ორი ელექტროდისაგან:
- ერთი ელექტრონების მიმწოდებელია Zn
- მეორე კი ელექტრონების მიმღები Cu.
გალვანური ელემენტის
ძაბვა მით უფრო მეტია, რაც უფრო მეტად განსხვავდებიან მეტალების სტანდარტული ელექტროდული
პოტენციალები, ანუ, რაც უფრო დაშორებული არიან მეტალები მეტალთა აქტიურობის მწკრივში
ერთმანეთისაგან.
Li – Cu -ის ელემენტები ფართოდ გამოიყენება
კალკულატორებში, ელექტრონულ საათებში და სხვ. მას ყველაზე დიდი ძაბვა აქვს U = 3,4 ვ
დღეს ფართო
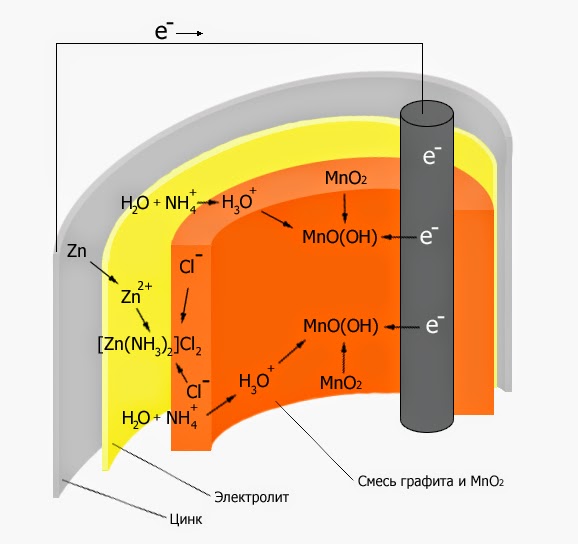
გამოყენება აქვს ლე კლანშეს ელემენტს , რომელიც ფრანგი ფიზიკოსის ლე კლანშეს მიერ შეიქმნა 1877 წელს.
C/NH4Cl/Zn
ანოდის როლს
ასრულებს გრაფიტი, ხოლო კადოდისას კი თუთია, დამაკავშირებელი ელექტროლიტია NH4Cl
ამონიუმის ქლორიდი. ძაბვა U=1,5ვ.
Li-იონის აკუმულატორი - გამოიყენება
მობილურ ტელეფონებში, ნოუთბუქებში, ციფრულ ფოტოაპარატებში,ვიდეოკამერებში. პირველი
Li-იონის აკუმულატორი 1991 წელს გამოუშვა Sony-ის კორპორაციამ. ნომინალური ძაბვა U = 3,6ვ , ხოლო მაქსიმალური 4,23ვ.
კათოდის როლს
ასრულებს - ალუმინის კილიტაზე ლითიუმ–კობალტის ოქსიდი LiCoO2, ხოლო ანოდისას
კი სპილენძის კილიტაზე ლითიუმი
Li და C (გრაფიტი), მუხტის გადამტანი
არის ლითიუმის იონი.
ავტომობილის
აკუმულატორი - ტყვია - მჟავური აკუმულატორი.
Pb/H2SO4/PbO2
კათოდის როლს
ასრულებს - ტყვია, ხოლო ანოდისას კი ტყვია, რომელიც დაფარულია ტყვიის ოქსიდის ფენით
PbO2, მუხტის გადამტანი არის
H2SO4.